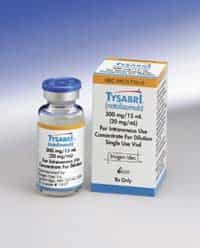
La Food and Drug Administration (FDA), ha approvato oggi la domanda di reintroduzione sul mercato del Tysabri, assoggettato ad un risretto e speciale sistema di distribuzione. Tysabri è un anticorpo monoclonale usato nel trattamento di pazienti con una ricaduta della sclerosi multipla per ridurre la frequenza delle esacerbazioni. Questo farmaco, indicato per un uso monoterapico, non deve essere usato assieme ad altre sostanze che agiscono sul sistema immunitario ed è consigliato alle persone che non hanno trovato giovamento da altri trattamenti per la sclerosi multipla. La storia del Tysabri risale a novembre 2004, quando la FDA diede l’approvazione alla sua commercializzazione, che venne però ritirata pochi mesi dopo (febbraio 2005) dallo stesso fornitore, perché tre pazienti, durante la sperimentazione clinica, svilupparono una forma di leucoencefalopatia multifocale progressiva (PML progressive multifocal leukoencephalopathy), infezione virale molto rara del cervello. La FDA a febbraio del 2006 ha concesso una ulteriore prova clinica dopo aver riesaminato le persone che si erano sottoposte alla precedente sperimentazione e dopo che la Biogen-Idec ha presentato un piano chiamato TOUCH per minimizzare i rischi e massimizzare la sicurezza dei tester. L’agenzia americana per la salute ha quindi accettato la messa in vendita del farmaco con le condizioni sancite dal piano di prescrizione TOUCH: – Il Tysabri potrà essere prescritto e somministrato solo dai centri registrati e contemplati nel programma. – I pazienti dovranno essere identificati e monitorati costantemente. – Prima della terapia farmacologica i pazienti dovranno sottoporsi ad una risonanza magnetica per facilitare la differenziazione dei sintomi della sclerosi multipla da quelli della PML. – Infine, i partecipanti al programma verranno visitati dopo 3 e 6 messi dalla prima assunzione e in seguito a cadenza regolare di 6 mesi in 6 mesi.
[via FDA]
Potrebbe interessarti
Aria Electronic Cigarette
In relazione all’articolo di sabato 25 luglio in cui la Food and Drug Administration ha lanciato un messaggio di allerta a riguardo della sigaretta elettronica, pubblico ora la replica della società AURIPEN S.r.l., produttrice di Aria Electronic Cigarette. — La società Auripen srl, in qualità di assemblatrice e distributrice di sigarette elettroniche, con la presente… Continua a leggere Aria Electronic Cigarette
Medio rischio per amalgama al mercurio
La Food and Drug Administration, l’agenzia statunitense che regolamenta i farmaci e gli ausili terapeutici, ha finalmente riclassificato l’amalgama dentale, il materiale usato per le otturazioni odontoiatriche che è da sempre oggetto di controversia perché composto per il 50 % da mercurio elementare, una sostanza potenzialmente tossica, e per il restante 50% da altri metalli… Continua a leggere Medio rischio per amalgama al mercurio
Monitor Nec
La Nec ha realizzato una nuova linea di monitor medicali con possibilità di visualizzare 12 bit di toni di grigio e calibrazione delle immagini Dicom. L’lcd offre un’elevata luminosità e brillantezza, senza compromettere il contrasto o l’angolo di visione, dando immagini ad alta qualità a colori e in bianco e nero. Le principali caratteristiche del… Continua a leggere Monitor Nec
Ricostruzione immagini 3D con VoXcell
La FDA ha recentemente approvato l’algoritmo per la ricostruzione delle immagini di KJAYA Medical. Il software VoXcell permette ai medici di passare da immagine 2D a immagini tridimensionali da un qualsiasi computer fisso o portatile collegato a internet. Il collegamento è fondamentale perché il laptop del clinico serve solo per visualizzare l’immagine che viene invece… Continua a leggere Ricostruzione immagini 3D con VoXcell