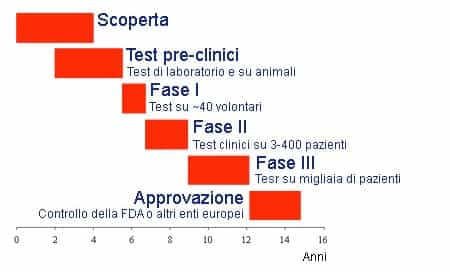
Sempre più spesso si legge nei giornali “scoperto nuovo farmaco per curare una xxx malattia”, ma quanto tempo intercorrerà affinché giunga effettivamente nelle farmacie? Il percorso che va dalla scoperta di un farmaco alla commercializzazione è molto lungo, mediamente 16 anni, ed è caratterizzato da più fasi, in ognuna delle quali vengono esaminate più caratteristiche per validarne l’efficacia e soprattutto la sicurezza. Queste fasi hanno un ordine ben preciso e se una non viene superata con successo, ovviamente non si procede oltre e il percorso viene arrestato, gettando via soldi e speranze. Scoperta In principio un nuovo farmaco è costituito da piccoli gruppi funzionali detti farmacofori in grado di intervenire su un bersaglio (target) per modificare, interrompere o evitare il decorso di una malattia. Test pre-clinici Dalle circa 10000 sostanze individuate annualmente dai medici e ricercatori, sottoposte ai test pre-clinici in vitro in cui vengono applicate a colture cellulari (modelli in vitro) per verificarne dapprima la biocompatibilità e la non citotossicità , solo il 2,5% viene ammesso alla fase successiva. In seguito vengono effettuati altri test più complessi su modelli animali (modelli in vivo) per verificare le reazioni dell’organismo vivente. Una cosa abbastanza interessante da tenere a mente è che una biocompatibilità e una efficacia del farmaco, ma lo stesso discorso vale anche per i biomateriali impiantati, nell’animale non comporta necessariamente una buona riuscita anche nell’uomo. Test clinici Accertato un certo grado di sicurezza per il farmaco (circa 1 su 10000) si passa ai test clinici sull’uomo divisi in tre fasi distinte e successive: fase I farmacologia clinica, fase II studio di efficacia e fase III studio multicentrico. La cosa che caratterizza maggiormente queste tre fasi è il numero di pazienti (volontari) che da circa una quarantina nella prima fase aumenta fino anche a decine di migliaia nella terza fase.
- Fase I: In questa fase vengono avviati gli studi sui meccanismi di farmacocinetica, farmacodinamica, metabolismo e biodisponibilità con apparecchiature sofisticate come l’esame pet. Si valutano anche i possibili effetti del farmaco a carico di altri organi e altre funzioni dell’organismo, i cosiddetti effetti collaterali: capita spesso infatti che un dato principio attivo agisca su più organi, a volte in modi diversi. In questo stadio si apportano gli ultimi ritocchi alla molecola del principio attivo, sia in termini di composizione chimica che di processo di produzione: se dopo questa fase vengono apportate modifiche alla molecola e/o al processo produttivo, il prodotto viene sottoposto di nuovo a tutte le sperimentazioni precliniche e cliniche.
- Fase II: Terminata l’analisi farmacologica, si passa a determinare l’efficacia terapeutica del nuovo farmaco. In alcuni selezionati centri ospedalieri dotati di comitati etici di controllo, che devono autorizzare sia il protocollo generale di sperimentazione che ogni singolo passo della sperimentazione stessa, si realizza una serie di studi sul campo, che comprendono sia una ulteriore affinamento dell’analisi sulla tossicità e sugli effetti collaterali sia degli studi in doppio cieco su pazienti (i paziente sono non sanno se il farmaco somministrato sia quello vero o un placebo), per misurare di quanto l’effetto del nuovo farmaco sia superiore all’effetto placebo, considerato come una specie di “zero farmaceutico”. Ogni paziente che partecipa alla sperimentazione deve essere informato puntualmente degli effetti del nuovo farmaco e dei potenziali rischi previsti, e firmare una dichiarazione di consenso informato.
- Fase III: Terminato con successo lo studio dell’efficacia clinica del nuovo farmaco (numero di pazienti trattati con successo col farmaco nettamente superiore a quelli trattati col placebo), si continua la sperimentazione allargando il numero di centri, cioè di ospedali e cliniche coinvolte, con l’obiettivo di confermare l’efficacia, affinare i dosaggi e la formulazione scelta, valutare il valore terapeutico, meglio definire il rapporto sicurezza efficacia, e superare il problema della variabilità individuale, cioè il problema delle possibili diverse reazioni su pazienti diversi.Terminata questa fase di sperimentazione si fa domanda di registrazione presso il Ministero della Sanità , per ottenere l’autorizzazione alla commercializzazione della nuova specialità farmaceutica (il medicinale vero e proprio). Durante le prime fasi della sperimentazione clinica (fase III compresa), il farmaco non è ancora in vendita ma può essere usato soltanto negli ospedali e soltanto sui pazienti selezionati che partecipano allo studio.
Infine, se tutte le fasi si sono concluse con un successo, il farmaco viene approvato e messo in vendita nelle farmacie, ma il percorso di valutazione non è finito: anche dopo la commercializzazione il nuovo farmaco viene tenuto sotto controllo per rilevare effetti collaterali e/o problemi eventualmente sfuggiti ai test clinici precedenti, perché si manifestano molto raramente o a lungo/lunghissimo termine, o solo in condizioni particolari in abbinamento ad altre sostanze ingerite. Chiaramente, a seguito di queste considerazioni, l’approvazione data a un farmaco può sempre essere revocata. Il meccanismo dalla scoperta alla vendita di un farmaco è molto lungo e in un certo senso giustifica i costi elevati che tocca pagare a noi utilizzatori finali. [riferimenti Fda | Aifa | Wikipedia]
Potrebbe interessarti
Sequestro del prodotto per bambini “Nimbus”, un errore
Negli ultimi 10 giorni erano in corso di esecuzione in varie ASL d’Italia ordini di sequestro per il prodotto nutraceutico per bambini “NIMBUS”, un coadiuvante nutrizionale per bambini distribuito da Nutrigea, utile per bilanciare efficacemente deficit di attenzione ed iperattività dei più piccoli. Il Ministero Salute aveva attivato misure restrittive per una presunta mancata notifica… Continua a leggere Sequestro del prodotto per bambini “Nimbus”, un errore
I cannabinoidi possibili farmaci per la cura dello stress
L’uso di cannabinoidi (marijuana) potrebbe essere utile per il trattamento dei pazienti con disturbo da stress post-traumatico. Lo domostra un nuovo studio effettuato presso il Learning and Memory Lab, Università di Haifa Dipartimento di Psicologia. Lo studio, svolto da una ricerca degli studenti Eti-Ganon Elazar sotto la supervisione di Irit Akirav, è stata pubblicata nel… Continua a leggere I cannabinoidi possibili farmaci per la cura dello stress
Farmaci biologici contro il dolore
Modificare il proprio stile di vita, impegnare parte del tempo e delle energie nella cura della patologia, incidendo pesantemente sui costi dell’assistenza socio-sanitaria. E’ quanto devono affrontare quotidianamente coloro che soffrono di malattie reumatiche, prima causa, secondo l’OMS, di dolore e disabilità in Europa e che, da sole, rappresentano la metà delle malattie croniche che… Continua a leggere Farmaci biologici contro il dolore
Epilessia del lobo temporale: nuova cura
Una recente ricerca italiana accende nuove speranze per i casi di epilessia resistente ai farmaci. Lo studio, pubblicato su ‘Pnas’, organo ufficiale dell’Accademia nazionale delle scienze Usa, e’ firmato dai ricercatori del Dipartimento di fisiologia e farmacologia dell’universita’ Sapienza di Roma, coordinati da Fabrizio Eusebi, in collaborazione con il Centro di neurochirurgia ‘Neuromed’ del Molise… Continua a leggere Epilessia del lobo temporale: nuova cura